1.1. Prélèvement de sang capillaire
1.1.1. Préparation
1.1.2. Sélection et préparation du site de ponction
1.1.3. Ponction et prélèvement
1.1.4. Après le prélèvement
1.2.1. Préparations générales
1.2.2.a) Prélèvement à partir d’un cathéter veineux
2.) Prélèvement sanguin à partir d’un cathéter veineux central
1.2.2.b) Ponction veineuse
1.) Ponction veineuse à l’aide d’une aiguille de sécurité
2.) Ponction veineuse à l’aide d’un Multifly® de sécurité
2. Conseils, techniques et pièges en préanalytique
2.1. Identification
2.2. Heure du prélèvement
1.1. Prélèvement de sang capillaire
Le sang capillaire est un mélange de sang provenant des artérioles, des veinules et des capillaires ainsi que des fluides interstitiels et intracellulaires. Si le prélèvement
de sang capillaire est souvent pratiqué en pédiatrie et en gériatrie, cette méthode est généralement utilisée sur les adultes, par ex., pour les analyses des gaz du sang
ainsi que le dosage du glucose et du lactate.
Cette technique ne permettant le prélèvement que de faibles quantités de sang, elle ne convient pas aux analyses nécessitant des volumes supérieurs à un millilitre,
auquel cas (par ex., hémocultures) il faut avoir recours à une ponction veineuse. De même, le sang capillaire ne convient pas aux analyses de coagulation. Les autres critères rendant impossible le prélèvement de sang capillaire sont les inflammations et les troubles circulatoires localisés près du site de ponction, comme cela peut être
le cas chez les patients hospitalisés à la suite d’un choc.
1.1.1. Préparation
1.) Rassembler le matériel nécessaire sur
le plateau de sécurité Safety Tray:
Gants jetables
Compresses
Désinfectant
Lancettes semi-automatiques à usage unique (lancettes de sécurité)
Tubes échantillons (par ex., capillaires pour gaz du sang, Microvettes, bandelettes réactives pour test de glycémie et instrument de mesure de glycémie).
Boîte à déchets Multi-Safe
Pansements adhésifs, si nécessaire (attention: non recommandé pour les enfants en bas âges en raison du risque d’ingestion) et matériel destiné à stimuler le flux sanguin (chiffon humide ou pommade hypercongestionnante)
2.) Identifier le patient
3.) Informer le patient de la raison du prélèvement sanguin et lui expliquer la procédure.
1.1.2. Sélection et préparation du site de ponction
1.) Sélection du site de ponction
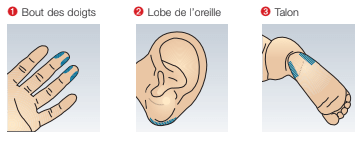
Dans la pratique, les sites de ponction généralement choisis pour le prélèvement de sang capillaire correspondent aux côtés de l’extrémité du majeur, de l’annulaire et de l’auriculaire, à la partie inférieure du lobe de l’oreille et, en particulier chez les nourrissons, aux parties latérales du talon.
La ponction sur le bout des doigts est généralement vécue comme une expérience désagréable et les patients préfèrent généralement que le prélèvement soit réalisé sur le lobe de l’oreille, cette pratique étant moins douloureuse. Il est déconseillé d’effectuer la ponction sur l’index et le pouce car il s’agit des doigts les plus fréquemment utilisés pour toucher et tenir les objets et cette pratique peut s’avérer relativement gênante pour les patients dans leur vie de tous les jours. C’est également la raison pour laquelle il est conseillé d’effectuer la ponction sur les doigts de la main «non dominante» du patient. Il convient auparavant de vérifier qu’aucun prélèvement de sang
capillaire n’a été récemment pratiqué sur le patient. Sous réserve que ce dernier ait une bonne circulation sanguine, il suffit généralement d’appuyer sur l’ancien site de ponction pour stimuler le flux sanguin, sans avoir à pratiquer une nouvelle ponction.
2.) Préparation du site de ponction
Le réchauffement du site de ponction permet un flux sanguin jusqu’à 7 fois supérieur à la normale, ce qui assure des conditions préalables optimales pour le prélèvement de sang capillaire. De plus, le fait de stimuler la circulation sanguine engendre une artérialisation du sang capillaire permettant une comparabilité acceptable avec les analyses obtenues avec du sang artériel et représente donc une condition préalable fondamentale pour obtenir des résultats représentatifs, notamment dans les analyses des gaz de sang capillaire.
Dans la pratique, la main ou le pied du patient est enveloppé dans un chiffon imbibé d’eau à 40 °C environ, maintenu en place pendant trois à cinq minutes. Pour des résultats optimaux, il est possible d’utiliser un gant en caoutchouc. Pour le prélèvement de sang capillaire chez les adultes, le lobe de l’oreille peut également être enduit d’une pommade hypercongestionnante.
Se désinfecter les mains.
Demander au patient de s’asseoir ou de s’allonger (pour éviter tout risque de chute).
Porter des gants jetables.
Assurer une accessibilité optimale du site de ponction: par ex., demander au patient de placer ses cheveux derrière les oreilles avant de procéder à la ponction du lobe.
Désinfecter le site de ponction (laisser sécher le désinfectant).
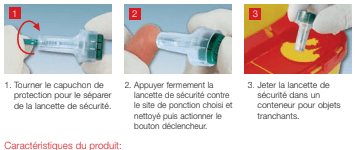
Tourner le capuchon pour le séparer de la lancette de sécurité (Fig. 1).
Appuyer la lancette de sécurité contre le site de ponction, prévenir le patient et actionner le bouton déclencheur (Fig. 2).
Jeter la lancette de sécurité dans la boîte à déchets Multi-Safe (Fig. 3).
1.1.3. Ponction et prélèvement
Après incision: éviter d’appuyer ou de malaxer le site de ponction pour empêcher le risque d’hémolyse et de contamination de l’échantillon avec le liquide tissulaire
Jeter la première goutte de sang.
Maintenir le membre ponctionné vers le bas.
Collecter la goutte de sang sur une bandelette réactive (par ex., pour une mesure de glycémie) ou à l’aide d’un capillaire end-to-end (par ex., pour une analyse des gaz du sang).
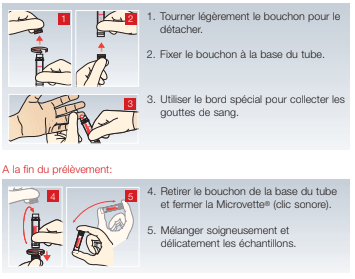
Lors d’un prélèvement à l’aide de la Microvette®, respecter l’ordre de prélèvement suivant pour éviter toute contamination:
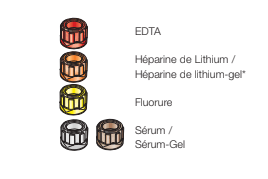
1.) EDTA
2.) Héparine de Lithium /Héparine de lithium-gel*
3.) Fluorure
4.) Sérum / Sérum-Gel
1.1.4. Après le prélèvement:
Appliquer une compresse sur le site de ponction ou demander au patient de tenir la compresse. Les résidus de pommade hypercongestionnante appliquée avant la ponction peuvent ensuite être retirés à l’aide d’une compresse de vaseline.
Si le patient en fait la demande, mettre un pansement adhésif sur le site
de ponction.
Jeter le matériel usagé selon les règles prescrites.
Se désinfecter les mains.
Procéder à l’analyse des échantillons sanguins.
Consigner le prélèvement sanguin et les résultats d’analyse.
Caractéristiques du produit:
En règle générale, le prélèvement de sang veineux correspond à la méthode retenue lorsque d’importants volumes de sang sont requis pour les diagnostics de
laboratoire (par ex, pour les hémocultures) ou lorsque d’autres raisons empêchent le prélèvement de sang capillaire, comme par exemple, si le patient est en état
de choc, en cas d’inflammations ou d’analyses de coagulation. Le sang veineux peut être prélevé à partir d’un cathéter déjà en place ou par ponction veineuse.
Différentes préparations sont disponibles pour répondre à une vaste gamme d’applications de diagnostic. Très pratiques, les tubes S-Monovette de
SARSTEDT sont couramment utilisés pour le prélèvement de sang veineux.

Pour éviter toute contamination des échantillons sanguins par des substances indésirables faussant inévitablement les résultats d’analyse, il convient de veiller à bien respecter l’ordre de prélèvement suivant lors d’un prélèvement sanguin avec la

Si le prélèvement doit se faire en ponctionnant directement la veine, l’aiguille de sécurité (Art. n° 85.1162.200) et les systèmes sécuritaires Multifly® de
sécurité (Art. n° 85.1638.235) peuvent être directement connectés à la S-Monovette®. Ces systèmes sécuritaires sont pourvus d’un dispositif spécial de protection de l’aiguille destiné à assurer la protection efficace des préleveurs contre les piqûres d’aiguille accidentelles après ponction veineuse.

1.2.1. Préparations générales
1.) Rassembler le matériel nécessaire sur le plateau de sécurité Safety Tray:
Compresses
Désinfectant
Serviette jetable (imperméable pour protéger les vêtements ou la literie du patient)
Garrot
Adaptateur multiple, aiguilles de sécurité, Multifly® de sécurité
Tubes échantillons (S-Monovettes, flacons d’hémoculture, etc.)
Pour le prélèvement par cathéters veineux à demeure: seringues préparées avec une solution physiologique stérile de chlorure de sodiumpour rincer le cathéter après ponction veineuse et bouchons à cône Luer intégré ou mandrins pour fermer le cathéter veineux.
Boîte à déchets Multi-Safe
Pansement adhésif
2.) Identifier le patient.
3.) Informer le patient de la raison du prélèvement sanguin et lui expliquer la procédure.
1.2.2.a) Prélèvement à partir d’un cathéter veineux
1.) Prélèvement à partir d’un cathéter périphérique à demeure (membres)
Se désinfecter les mains.
Demander au patient de s’asseoir ou de s’allonger (risque de chute).
Porter des gants jetables.
Désinfecter le raccord Luer du cathéter déjà en place et le relier à un adaptateur multiple.
Placer le membre sous le niveau du cœur sur une serviette imperméable jetable.
Poser le garrot 10 à 15 cm au-dessus du cathéter à demeure. Veiller à ce qu’une courte constriction suffise à faciliter le remplissage de la veine (le pouls doit toujours être palpable au-dessus de la constriction).
Fixer la S-Monovette® à l’adaptateur multiple en tournant dans le sens horaire.
Desserrer le garrot et tirer lentement le piston de la S-Monovette® jusqu’à ce qu’il se bloque dans la base de cette dernière (attention: si le piston est tiré trop vite, une hémolyse risque de se produire). Si l’afflux de sang s’arrête, interrompre brièvement l’aspiration puis, après une courte pause, continuer à tirer le piston. Si nécessaire, resserrer le garrot pour que la veine se remplisse.
Détacher la S-Monovette® de l’adaptateur multiple en tournant dans le sens antihoraire. En cas de prélèvements multiples, fixer une nouvelle
S-Monovette® et procéder de la façon décrite ci-dessus. Si le patient a été placé sous perfusion avant le prélèvement, jeter la première
S-Monovette® afin d’éviter que les résidus de la perfusion ne faussent les résultats d’analyse.
Retirer l’adaptateur multiple et le jeter dans la boîte à déchets Multi-Safe.
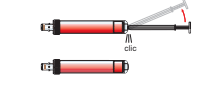
Tirer le piston des tubes S-Monovette remplis jusqu’à audition d’un ‘clic’ et casser la tige.
Rincer le cathéter veineux avec une solution physiologique de chlorure de sodium, désinfecter l’adaptateur Luer (retirer le reste de sang à l’aide d’une compresse imbibée de désinfectant) et le fermer à l’aide d’un bouchon à cône Luer intégré ou poursuivre le traitement par perfusion.
Mélanger soigneusement mais délicatement les S-Monovettes préparées des anticoagulants

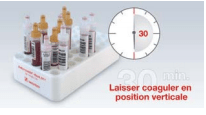
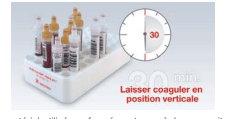
Conserver les S-Monovettes Sérum et Sérum-gel pendant au moins 30 minutes en position verticale pour éviter la formation d’une «saucisse» qui ne permet la récupération que d’une très faible quantité de sérum.
Jeter tout le matériel utilisé conformément aux règles prescrites.
Se désinfecter les mains.
Veiller à ce que les échantillons sanguins soient bien envoyés au laboratoire pour analyses.
Consigner la procédure dans le dossier du patient.
2.) Prélèvement sanguin à partir d’un cathéter veineux central
Se désinfecter les mains.
Demander au patient de s’asseoir ou de s’allonger (risque de chute).
Porter des gants jetables.
Désinfecter le raccord Luer du cathéter veineux central ou le robinet trois voies placé à proximité et le relier à un adaptateur multiple.
Fixer la S-Monovette® à l’adaptateur multiple en tournant dans le sens horaire.
Tirer lentement le piston de la S-Monovette® jusqu’à ce qu’il se bloque dans la base de cette dernière (attention: si le piston est tiré trop vite, une hémolyse risque de se produire). Jeter la première S-Monovette® pour éviter que les résidus de la perfusion ne faussent les résultats d’analyse.
Détacher la S-Monovette® de l’adaptateur multiple en tournant dans le sens antihoraire. En cas de prélèvements multiples, fixer une nouvelle
S-Monovette® et procéder de la façon décrite ci-dessus.
Retirer l’adaptateur multiple et le jeter dans la boîte à déchets Multi-Safe.
Tirer le piston des tubes S-Monovette remplis jusqu’à audition d’un ‘clic’ et casser la tige.
Rincer le cathéter veineux avec une solution physiologique de chlorure de sodium, désinfecter l’adaptateur Luer (retirer le reste de sang à l’aide d’une compresse imbibée de désinfectant) et le femer à l’aide d’unbouchon à cône Luer intégré ou poursuivre le traitement par perfusion.
Mélanger soigneusement mais délicatement les S-Monovettes préparées des anticoagulants.
Conserver les S-Monovettes Sérum et Sérum-gel pendant au moins 30 minutes en position verticale pour éviter la formation d’une «saucisse» qui ne permet la récupération que d’une très faible quantité de sérum.
Jeter tout le matériel utilisé conformément aux règles prescrites.
Se désinfecter les mains.
Veiller à ce que les échantillons sanguins soient bien envoyés au laboratoire pour analyses.
Consigner la procédure dans le dossier du patient.
1.2.2.b) Ponction veineuse
En règle générale, la méthode la plus courante de prélèvement sanguinconsiste à piquer directement une veine superficielle. Les sites de ponction se situent habituellement sur les membres supérieurs ainsi que sur les veines du cou-de-pied ou sur les veines épicrâniennes (par ex., chez les nourrissons).
Procédure:
Se désinfecter les mains.
Demander au patient de s’asseoir ou de s’allonger (risque de chute).
Porter des gants jetables.
Placer le membre sous le niveau du cœur sur une serviette imperméable jetable.
Poser le garrot 10 à 15 cm au-dessus du cathéter à demeure. Veiller à cequ’une courte constriction suffise à faciliter le remplissage de la veine (le pouls doit toujours être palpable au-dessus de la constriction).
Mauvais état des veines: demander au patient de serrer le poing. Tapoter délicatement la veine ou recouvrir les sites de ponction d’un chiffon préalablement chauffé.
Piquer la veine choisie et desserrer le garrot. Les veines les plus adaptées à la ponction veineuse sont les veines bien palpables, qui rebondissent légèrement lorsqu’on les touche avec un doigt, facilement visibles et de préférence, ramifiées pour une fixation optimale.
Principales veines pour prise de sang à l’intérieur de l’avant-bras et dans le pli du coude:
Veine céphalique
Veine médiane du coude
Veine basilique
Veine médiane de l’avant-bras
Artère humérale(Attention: risque de ponction artérielle non intentionnelle)
Attention: Le fait de serrer et de desserrer le poing (action de «pompage») pour accroitre le flux sanguin implique une activité musculaire qui entraîne une hausse de K+
et Mg2+.
Une constriction prolongée modifie les paramètres tels que K+ ou gamma-GT et entraîne une hémoconcentration qui se traduit par la modification de plusieurs autres paramètres.
1.) Ponction veineuse à l’aide d’une aiguille de sécurité
Désinfecter le site de ponction. Après application, laisser sécher le désinfectant. Poser de nouveau le garrot. Pour des raisons d’hygiène, ne pas retoucher le site de ponction.
Fixer l’aiguille de sécurité à la S-Monovette® en tournant légèrement dans le sens horaire.
Utiliser le pouce de la main libre pour tirer la peau et maintenir la veine en place. Avertir le patient et piquer la veine à un angle de 30° avec le côté biseauté de l’aiguille, ouverture orientée vers le haut.
Desserrer le garrot et tirer lentement le piston de la S-Monovette® jusqu’à ce que le sang s’arrête de couler. En cas d’utilisation d’aiguilles de faible diamètre, ne pas tirer le piston trop vite afin d’empêcher l’hémolyse. Si l’afflux de sang s’arrête, interrompre brièvement l’aspiration et après une courte pause, continuer à tirer le piston. Si nécessaire, repositionner la pointe de l’aiguille ou resserrer le garrot le temps que la veine se remplisse.
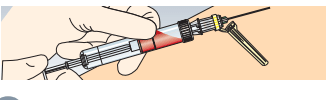
Retirer la S-Monovette® de l’adaptateur multiple en tournant dans le sens antihoraire. En cas de prélèvements multiples, fixer la nouvelle S-Monovette et effectuer le prélèvement de la façon susmentionnée.
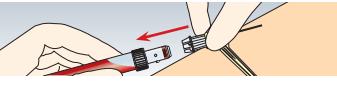
Après avoir retiré la dernière S-Monovette®, appliquer une compresse sur le site de ponction. Tenir l’aiguille de sécurité au niveau de l’adaptateur etla retirer de la veine. Appliquer une compresse sur le site de ponction et demander au patient d’appuyer dessus pendant 5 minutes jusqu’à ce que le sang s’arrête de couler. Conseiller au patient de ne pas plier le bras mais de l’étendre et de le tenir bien au-dessus du niveau du cœur afin d’éviter la formation d’hématomes près du site de ponction. Dès que le sang s’arrête de couler, appliquer si nécessaire un pansement adhésif sur
le site de ponction.
Placer le protecteur de l’aiguille de sécurité sur une surface plane et stable et appuyer jusqu’à audition d’un ‘clic’ pour y insérer l’aiguille.
Après activation du protecteur d’aiguille, mettre l’aiguille au rebut conformément aux règles prescrites.

Tirer le piston des S-Monovettes remplies jusqu’à audition d’un ‘clic’ et casser la tige.
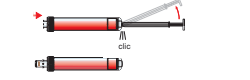
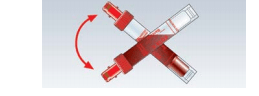
Mélanger soigneusement mais délicatement les S-Monovettes préparées avec les anticoagulants.
Conserver les S-Monovettes Sérum et Sérum-gel pendant au moins 30 minutes en position verticale pour éviter la formation d’une «saucisse» qui ne permet la récupération que d’une très faible quantité de sérum.
Jeter tout le matériel utilisé conformément aux règles prescrites.
Se désinfecter les mains.
Veiller à ce que les échantillons sanguins soient bien envoyés au laboratoire pour analyses.
Consigner la procédure dans le dossier du patient.
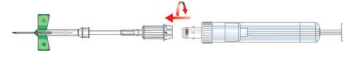
2.) Ponction veineuse à l’aide d’un Multifly® de sécurité
Désinfecter le site de ponction. Après application, laisser sécher ledésinfectant. Poser de nouveau le garrot. Pour des raisons d’hygiène, nepas retoucher le site de ponction.
Utiliser le pouce de la main libre pour tirer la peau et maintenir la veine en place. Avertir le patient et piquer la veine à un angle de 30° avec le côté biseauté de l’aiguille, ouverture orientée vers le haut. Une baisse de résistance notable et l’afflux de sang dans le tube du Multifly® de sécurité confirme le succès de la ponction veineuse.
Fixer la S-Monovette® à l’adaptateur du Multifly® de sécurité en tournant légèrement dans le sens horaire.
Bien garder à l’esprit le fait que l’air contenu dans le tube est aspiré dans la première S-Monovette®, ce qui peut fausser le rapport de mélange pour la vitesse de sédimentation et la coagulation. Il faut donc jeter le premier tube pour éviter d’obtenir des résultats erronés.
Desserrer le garrot et tirer lentement le piston de la S-Monovette® jusqu’à ce que le sang s’arrête de couler. En cas d’utilisation d’aiguilles de faible diamètre, ne pas tirer le piston trop vite afin d’empêcher l’hémolyse. Si l’afflux de sang s’arrête, interrompre brièvement l’aspiration et après une courte pause, continuer à tirer le piston. Si nécessaire, repositionner la pointe de l’aiguille ou resserrer le garrot le temps que la veine se remplisse.
Retirer la S-Monovette® de l’adaptateur multiple en tournant dans le sens antihoraire. En cas de prélèvement de plusieurs échantillons, fixer la nouvelle S-Monovette et effectuer le prélèvement de la façon susmentionnée.
Après avoir retiré la dernière S-Monovette®, appliquer une compresse sur le site de ponction. Tenir le Multifly® de sécurité au niveau de sonextrémité arrière entre le pouce et l’index et le retirer de la veine en appuyant légèrement le tube contre la paume de la main. Appliquer une compresse sur le site de ponction et demander au patient d’appuyer dessus pendant 5 minutes jusqu’à ce que le sang s’arrête de couler.
Conseiller au patient de ne pas plier le bras mais de l’étendre et de le tenir bien au-dessus du niveau du cœur afin d’éviter la formation d’hématomes près du site de ponction. Dès que le sang s’arrête de couler, appliquer si nécessaire un pansement adhésif sur le site de ponction.
Tenir le protecteur d’aiguille du Multifly® de sécurité entre le pouce et l’index et pousser le protecteur sur l’aiguille jusqu’à ce qu’elle soit effectivement et visiblement insérée dans l’étui de protection.

Après activation du protecteur d’aiguille, mettre le Multifly® de sécurité au rebut conformément aux règles prescrites.

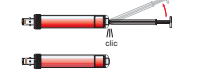
Tirer le piston des S-Monovettes remplies jusqu’à audition d’un ‘clic’ etcasser la tige.
Mélanger soigneusement mais délicatement les S-Monovettes préparées avec les anticoagulants.

Conserver les S-Monovettes Sérum et Sérum-gel pendant au moins 30 minutes en position verticale pour éviter la formation d’une «saucisse» qui ne permet la récupération que d’une très faible quantité de sérum.
Jeter tout le matériel utilisé conformément aux règles prescrites.
Se désinfecter les mains.
Veiller à ce que les échantillons sanguins soient bien envoyés au laboratoire pour analyses.
Consigner la procédure dans le dossier du patient.
2. Conseils, techniques et pièges en préanalytique
Le préanalytique désigne toutes les procédures préalables au travail de laboratoire, c’est-à-dire, avant analyse. A ce stade, les résultats d’analysesont exposés à une multitude de facteurs de risque, que ce soit pendant la préparation du prélèvement, pendant la réalisation de ce dernier ou pendant le stockage ou le transport des échantillons sanguins. Si les erreurs en préanalytique ont généralement un gros impact sur les résultats d’analyse, les erreurs en matière analytique de laboratoire n’entraînent généralement que des changements mineurs des résultats d’analyse. Il est donc fortement
conseillé de vérifier l’absence d’erreurs dans les phases de travail préanalytique en cas d’obtention de résultats suspects.
2.1. Identification
En préanalytique, les erreurs correspondent aux chiffres placés avant la virgule.
En analytique de laboratoire, les erreurs correspondent aux chiffres placés après la virgule.
1.) Patient
L’identification correcte du patient est déterminante dans les analyses de laboratoire. Elle doit toujours inclure les nom, prénom(s) et date denaissance du patient. Selon les règles de procédure de l’établissement, le numéro d’admission ou numéro d’identification du patient ainsi que, dans les hôpitaux, le service et le numéro de chambre peuvent être ajoutés pour compléter le dossier du patient.
Les erreurs ne se produisent pas seulement avec les noms de famille les plus répandus et peuvent entraîner une interprétation complètement erronée des résultats d’analyse. L’identification du patient doit donc toujours être confirmée juste avant le prélèvement en s’adressant directement au patient. Les questions rhétoriques telles que «Vous êtes bien M. Dupont, n’est-ce pas?» ne répondent pas à l’objectif visé car les patients totalement ou partiellement malentendants ou souffrant de troubles
cognitifs peuvent très bien répondre d’un signe de tête affirmatif. De même, une personne assise au bord du lit peut être un simple visiteur.
2.) Echantillon
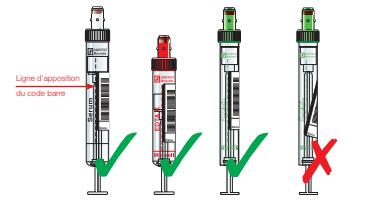
Pour éviter tout risque de mélange des échantillons, les tubes qui ne sont pas clairement identifiés ne seront pas analysés par le laboratoire. Ils doivent toujours porter une inscription bien lisible pour permettre leur traitement correct. Pour des raisons de sécurité, l’identification doit être apposée sur le tube primaire, jamais sur le bouchon, l’emballage extérieur ou encore le conteneur de transport. Dans la pratique, les étiquettes à code-barres correspondent à la méthode choisie pour garantir l’identification fiable des échantillons pendant toutes les phases de travail impliquées et permettent d’éviter les erreurs possibles liées à une inscription manuscrite
illisible sur le tube échantillon.
Les tubes échantillons sont correctement étiquetés à condition que:
la visibilité du contenu du tube ne soit pas entravée
le volume de remplissage puisse être contrôlé
leur bouchon à vis puisse être facilement retiré
le tube et l’étiquette ne restent pas coincés ni collés dans la centrifugeuse.
Indiquer clairement sur le tube et le formulaire de demande qu’il s’agit d’une substance infectieuse afin de protéger les tiers contre les risques inhérents d’infection.
3.) Formulaire de demande
Outre les informations sur les paramètres à analyser, le formulaire de demande doit également renseigner l’identité du médecin prescripteur ainsi que son numéro de téléphone fixe ou mobile pour faciliter la prise de plus amples renseignements par le personnel du laboratoire, par exemple, en
cas de:
demandes illisibles
demandes erronées (par ex., phosphatase prostatique pour un patient de sexe féminin).
limitation aux paramètres essentiels en cas d’échantillons de petit volume.
L’identité du préleveur doit être renseignée pour chaque échantillon prélevé ainsi que, si possible, sur le formulaire de demande. C’est le seul moyen de répondre efficacement et sans délai aux questions relatives au type et au moment du prélèvement sanguin ainsi qu’aux éventuels problèmes survenus au cours de la prise de sang, à l’état du patient et à d’autres sujets importants en cas de résultats d’analyse suspects.
2.2. Heure du prélèvement
Les analyses de sang étant généralement destinées à surveiller le cours decertains paramètres de laboratoire, il est conseillé de toujours effectuer le prélèvement à la même heure. La procédure normalisée tient compte du fait que plusieurs paramètres de laboratoire sont connus pour subir des fluctuations circadiennes et que dans la majorité des cas, les plages standard correspondantes fixées pour les prélèvements sanguins sont fixées le matin, avant le petit- déjeuner ou la prise de médicaments. Par conséquent, les prises de sang sont généralement effectuées:
Entre 7h00 et 9h00 du matin, à jeun, après une période de jeûne de 12 heures
Avant toute prise de médicaments par le patient.
Sont exclus de ce prélèvement normalisé les paramètres devant être analysés pour un diagnostic urgent ou destinés à un suivi plus méticuleux du diagnostic et du traitement
Alimentation
L’alimentation a une grosse influence sur bon nombre de paramètres de laboratoire. Les concentrations de glucose et de triglycéride en particulier sont réputées pour augmenter rapidement après ingestion d’aliments. Une période de jeûne de 12 heures avant prélèvement est donc généralement conseillée chaque fois que les diagnostics cliniques semblent l’indiquer. L’analyse decertains paramètres peut nécessiter un jeûne plus long de sorte qu’en cas de doute, le laboratoire compétent puisse être consulté pour de plus amples renseignements.
Plusieurs autres paramètres tels que par exemple la phosphatase alcaline et ses isoenzymes, l’alanine, l’aminotransférase, le phosphate inorganique, la bilirubine,
le cholestérol, la dopamine, le fer, les protéines, les acides gras libres, l’acide folique, la gastrine, l’acide urique, l’urée, l’insuline, le potassium, le calcium, les
catécholamines, le cortisol, le cuivre, les leucocytes, le magnésium, le sodium,
la parathormone, l’hormone de croissance, le zinc, etc. subissent également des modifications induites par l’alimentation. Le jeûne avant prélèvement est donc
indiqué dès lors que ces paramètres sensibles doivent être analysés. En ce qui concerne les analyses de coagulation, le fait de manger n’affecte en rien les résultats. Si des paramètres isolés de coagulation doivent être déterminés, le patient peut prendre un léger petit-déjeuner mais des aliments maigres doivent être servis pour éviter la turbidité du plasma lors des analyses qui suivent.
Prise de médicaments
Les valeurs mesurées de nombreux paramètres de laboratoire sont affectées par la prise de certains médicaments avant le prélèvement sanguin. Pour autant que
le tableau clinique du patient justifie une telle décision, l’administration de médicaments doit être repoussée après le prélèvement ou interrompue plusieurs jours avant afin de ne pas fausser les résultats d’analyse.
Le suivi des taux sanguins altérés par les médicaments implique la mesure des valeurs planchers des produits pharmaceutiques dans le sang pour refléter la concentration de médicaments juste avant la prise de la dose suivante (concentration minimale stable). Par conséquent, les médicaments ne doivent pas être administrés avant la fin du prélèvement sanguin.
L’exception à cette règle concerne les analyses réalisées en cas de suspicion de surdose ou d’intoxication médicamenteuse, ainsi que l’analyse des valeurs pics juste après administration d’un médicament particulier. En fait, ces situations se limitent à un nombre restreint de cas cliniques bien particuliers.
Exercice physique et procédures thérapeutiques ou diagnostiques
Un certain nombre de procédures thérapeutiques ou diagnostiques ainsi que l’exercice physique avant le prélèvement sanguin peuvent fausser les résultats
d’analyse et il est donc conseillé de réaliser toutes les analyses de laboratoire requises avant de débuter ces procédures.
Ces mesures diagnostiques incluent par exemple la palpation de la prostate qui peut contribuer à accroître l’acide phosphatase, ou toute intervention chirurgica-
le susceptible d’interférer sur la vitesse de sédimentation (V.S.) en faisant aug- menter le taux de protéines de phase aiguë. Les injections intramusculaires peuvent faire grimper le taux des enzymes musculaires telles que la créatine kinase (CK) ou la myoglobine en raison des lésions infligées aux cellules.
De même, l’activité physique préalable du patient peut également influer sur les résultats d’analyse. La fluctuation temporaire du fluide entre le compartiment intra-vasculaire et le compartiment interstitiel est très fréquente, ce qui élève le taux de protéines et de cellules sanguines dans le diamètre de ces comparti-
ments. Après un effort physique important, les patients risquent fort de réagir par une augmentation des enzymes musculaires telles que, par exemple, CK, AST
(GOT) et LDH, ce qui peut fausser l’interprétation des résultats d’analyse.
Par conséquent, il est conseillé au patient de rester en position debout ou allongée pendant 10 minutes avant le prélèvement et de s’abstenir de faire le moindre effort physique. Pour garantir des résultats d’analyse précis et représentatifs, les procédures thérapeutiques ou diagnostiques doivent être reportées après la fin du prélèvement.